Qualitätsmanagementsystem für Medizinprodukte
DIN EN ISO 13485
Medizinprodukte unterteilen sich in zwei generelle Gruppen. Die erste Gruppe sind alle solche Produkte, die am Menschen direkt angewendet werden (in-Vivo). Die zweite Gruppe sind sogenannte IVD's (In-Vitro Diagnostika). Wie der Name es bereits sagt, werden hier Proben menschlichen Ursprungs untersucht.
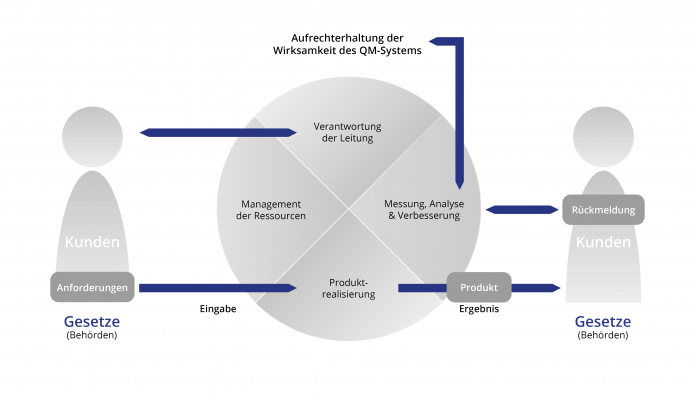
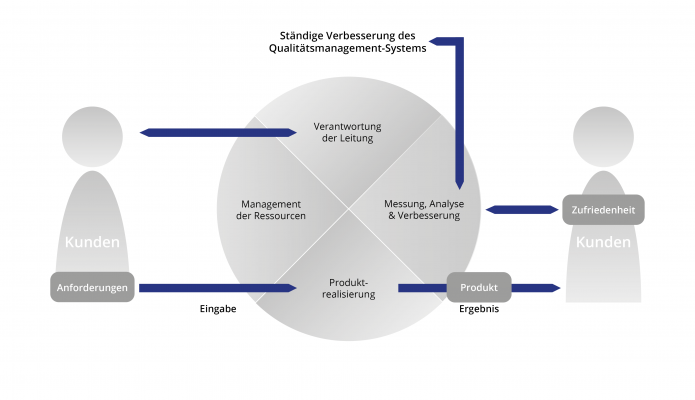
Produkte und Dienstleistungen im Bereich der Medizinprodukteindustrie unterliegen hohen Anforderungen. Grundsätzlich wird an Medizinprodukte die Forderung gestellt, dass sie Patienten, Anwender und Dritte bei sachgemäßer Installation, Instandhaltung und bestimmungsgemäßen Gebrauch nicht gefährden, dass sie ihre medizinische Zweckbestimmung auch nachweislich erfüllen und dass die mit ihrer Anwendung verbundenen Restrisiken – im Vergleich zum Nutzen – vertretbar sind. Ein QM-System nach EN ISO 13485 kann Hersteller und Dienstleister bei der Umsetzung dieser Pflichten unterstützen.
Wer ist betroffen?
Die Norm DIN EN ISO 13485 bildet die Grundlage zur Zertifizierung von Qualitätsmanagementsystemen von Unternehmen, die Medizinprodukte „auf dem Markt bereitstellen“– d. h. entwickeln, herstellen, vertreiben, betreiben bzw. anwenden. – oder für Lieferanten, die in den Lebenszyklus eines Medizinproduktes involviert sind (z. B. Entwicklung, Produktion, Materialzulieferung, Lagerung, Distribution, Service, Installation, Sterilisation, Wiederaufbereitung, Entsorgung etc.).
Die Zertifizierung nach der DIN EN ISO 13485 ist die Basis für eine gemeinsame Sprache von Hersteller und Zulieferer und bietet die Möglichkeit der gemeinsamen einheitlichen Festlegung der Qualitätsstandards und der Harmonisierung der Abläufe.
Was sind die Vorteile der DIN EN ISO 13485?
Obwohl es keine Verpflichtung für eine Zertifizierung gibt, kann es sinnvoll sein, dass Einrichtungen und Unternehmen im Gesundheitswesen sich die Wirksamkeit ihres Qualitätsmanagementsystems durch externe, unabhängige Stellen bestätigen lassen.
Ein Qualitätsmanagementnach DIN EN ISO 13485 stellt heute eine selbstverständliche, allgemein akzeptierte Voraussetzung für sämtliche Bereiche der Medizinproduktefertigung dar. Eine Zertifizierung nach 13485 ist für Dienstleister im Bereich der Medizintechnik ein Wettbewerbsvorteil, denn eine Zertifizierung ist mittlerweile für viele Hersteller von Medizinprodukten die Voraussetzung für die externe Auftragsvergabe.
Wenn das QMS der Lieferanten bereits nach DIN EN ISO 13485 durch eine akkreditierte Stelle zertifiziert ist, besteht für den Hersteller die Möglichkeit die Auditierung des Zulieferers zu reduzieren.
Auch aus Sicht des Lieferanten und Dienstleisters eines Medizinprodukteherstellers stellt eine Zertifizierung basierend auf den im Unternehmen etablierten Prozessen nach DIN EN ISO 13485 einen echten Mehrwert dar. Zum einem reduziert es immer wiederkehrende Audits durch unterschiedliche Kunden, zum anderen dient die Zertifizierung als Aushängeschild gegenüber potenziellen Kunden, die sich bei der Lieferantenauswahl auf zertifizierte Prozesse stützen können.
Mit der Zertifizierung nach der Norm DIN EN ISO 13485 unterstreicht der Zulieferer die Zuverlässigkeit und Konformität seiner Komponenten und/oder seiner Dienstleistung.
Ablauf der Zertifizierung nach der DIN EN ISO 13485
Die Zertifizierung nach der DIN EN ISO 13485 folgt einem 3-jährigen Rhythmus:
Erstzertifizierung > 1. Überwachung > 2. Überwachung > 3. Re-Zertifizierung